平成27年度 入学者のみなさんに
第8章 酵素とエネルギーBIOLOGY
8-1 蛋白質の構造
アミノ酸どうしがペプチド結合によって結合したものをペプチドまたはペプタイドという。
アミノ酸が2個結合したものをジペプチド、アミノ酸が3個結合したものをトリペプチドという。
多数のアミノ酸がペプチド結合したものをポリペプチドといい、多くのタンパク分子は数十から数百のアミノ酸からなるポリペプチドである。
ヒトを構成するタンパク質の種類は10万種と言われている。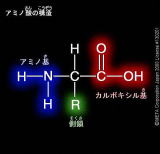
タンパク質をその働きによって構造タンパク質と機能タンパク質に分類する。
構造タンパク質は生物体内の種々の構造を作り、細胞、組織、器官に機械的強度をもたせている。代表例は毛髪のケラチン、皮膚や軟骨のコラーゲンなどである。
機能タンパク質には酵素、ホルモン、運搬輸送タンパク質、運動タンパク質、防御タンパク質がある。
酵素は化学反応を促進するもので、代表例はアミラーゼである。
ホルモンは生物体内の種々の生理作用を調節する働きを持ち、代表例はインスリンである。

運搬輸送タンパク質は細胞膜中に存在して物質の輸送を行ったり、血液中に存在して物質を運搬したりしている。
代表例はナトリウムポンプともいわれるNa+-K+-ATPアーゼ、血液中の酸素を運搬するヘモグロビンなどである。
運動タンパク質は筋収縮などの運動をおこすもので、代表例は筋のアクチンやミオシンである。
防御タンパク質は細菌やウイルスに結合したり、血液凝固に関与したりするタンパク質である。
代表例は免疫グロブリン、血液凝固に関するフィブリンなどである。
なお、へび毒、破傷風毒素などは毒素タンパク質と呼ばれる。
8-2 酵素蛋白
化学反応を促進する働きを持つが、それ自身は化学反応の前後で変化しない物質を触媒という。
そして生物由来の触媒を酵素という。
酵素が作用する相手の物質を基質といい、酵素が関与することでおこる酵素反応で生じる物質を生成物という。
酵素が基質に作用する力を酵素の活性といい、通常は単位時間当たりの変化量である反応速度であらわされる。
酵素の活性がなくなり、もとにもどらなくなることを失活という。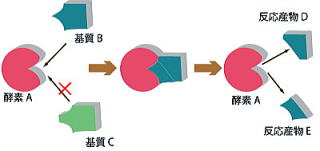
酵素は主成分がタンパク質なので二酸化マンガンなどの無機触媒とは異なった性質を持つ。これを酵素の特性という。具体的には基質特異性がある、最適温度を持つ、最適pHを持つことである。
特定の酵素は特定の基質にしか働かない。これを酵素の基質特異性という。たとえばアミラーゼはでんぷんを分解することはできるが、麦芽糖、別名マルトースを分解することはできない。
ただしどの酵素も作用する基質は1種類だけとは限らない。アミラーゼはグリコーゲンも分解することができる。つまり、限られた物質にのみ作用するということである。
酵素反応には最も活発になる温度、範囲があり、この温度を最適温度という。通常は30-40度である。無機触媒では最適温度は存在せず、反応速度は温度の上昇とともに大きくなる。
酵素反応には最も活発になるpHがあり、この温度を最適pHという。ペプシンではpH2、唾液アミラーゼはpH7、トリプシンはpH8である。
酵素の中にはポリペプチド鎖の一部が切り離されると活性を示すものがある。
たとえばタンパク質分解酵素であるペプシンはペプシノーゲンと呼ばれる不活性な酵素として胃の細胞から分泌されるが、胃液中の塩酸によって分子の一部が切り離されてペプシンになる。
胃の細胞内では活性化していないので、胃の細胞を構成するタンパク質を分解することはないし、胃の内壁は粘液に覆われているので、ペプシンになってからも内壁の細胞のタンパク質を分解することはない。
8-3 呼吸とATP
生体のエネルギー代謝で、重要な働きを担うのはATPと呼ばれる物質である。
生体は細胞の中でATPという物質を作ってエネルギーを蓄え、そして細胞が機能する時、筋肉を収縮させる時などに少しずつ、これを使っている。
ATPはアデニンという塩基とリボースという糖が結合したアデノシンに3個のリン酸が結合した物質でアデノシン三リン酸の略称である。
ADPという物質にエネルギーをくっつけてATPとしてエネルギーを蓄えておく。エネルギーを使いたい時はATPからエネルギーを取り出す。この時、ATPはADPになる。
ヒトの生命活動を維持するために、1日に細胞内で数千回、ATPの合成と分解が繰り返されている。ATPはヒトから細菌まですべての生物に共通した物質なので、エネルギーの通貨に例えられる。
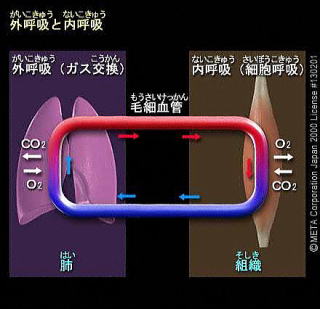
呼吸は細胞が有機物を分解してエネルギーを取り出すことと定義されている。この際、結果としてATPができる。
通常の細胞呼吸ではグルコースが用いられ、二酸化炭素と水にまで完全に酸化される。この時にATPが生成される。
好気呼吸によるグルコースの分解反応は解糖系、クエン酸回路、電子伝達系の3つの過程に分けられる。
解糖系は細胞質基質で進行する。
クエン酸回路、電子伝達系はミトコンドリアの中で進行する。
8-4 筋収縮とATP
筋肉には横紋筋と平滑筋がある。
横紋筋は骨格筋と心筋に分けられる。
骨格筋は主に骨に付着して骨を動かしている。運動神経に支配される随意筋である。
筋繊維の核は多核で、横紋がある。顕微鏡で観察すると一本の筋繊維が筋細胞になっており、その中に核が多数存在する。
心筋は心臓を構成している。自律神経に支配される不随意筋である。筋繊維の核は1-2個で、横紋がある。顕微鏡で観察すると筋繊維つまり筋細胞が枝分かれしている。
平滑筋は消化管、子宮、血管などの壁を構成している。自律神経に支配される不随意筋である。
筋繊維の核は1個で、横紋がない。顕微鏡で観察すると一本の筋繊維が筋細胞になっている。
骨格筋は筋繊維と呼ばれる巨大な筋細胞からできている。幅が約0.1mmで長さは数cmある。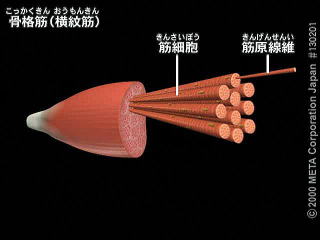
筋繊維内には筋原繊維(きんげんせんい)と呼ばれる円筒状の構造が束になって存在している。
筋原繊維には明帯と暗帯とが交互に配列し、これらの配列位置がそろっているので、骨格筋の筋繊維には横紋がみられる。
明帯の中央にはZ膜(Z盤)という仕切りがあり、Z膜とZ膜の間にはサルコメア、日本語で筋節と呼ばれ、これが筋原線維の構造上の単位になっている。

筋繊維内には平行に並んだ2種類の筋フィラメントがみられる。
太いフィラメントはミオシンというタンパク質分子が束になってできたミオシンフィラメントであり、細いフィラメントは主にアクチンというタンパク分子からなるアクチンフィラメントである。
ミオシンフィラメントは暗帯にある。アクチンフィラメントは明帯にあり、その先端を暗帯まで伸ばしている。
筋繊維の周りには神経線維やその終板が付着している。
1本のニューロンの末端は枝分かれし、それぞれの筋繊維に接合している。
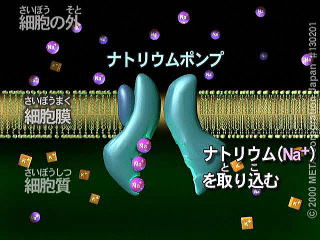
8-5 細胞膜とナトリウムポンプ
細胞膜はリン脂質の二重層にタンパク質がモザイク状に埋め込まれているような構造をしている。
細胞膜のリン脂質二重層は酸素、二酸化炭素、水などの小さい分子は自由に通すが、有機物などの大きな分子やイオンは通さない。しかしその他の物質を輸送する特別な輸送タンパク質も細胞膜に組み込まれている。
細胞膜には濃度差に逆らってイオンを輸送するしくみがある。
このしくみは輸送タンパク質によって構成され、ポンプと呼ばれる。
代表的なのはナトリウムポンプである。
ナトリウムポンプを構成する輸送タンパク質はNa+- K+-ATPアーゼという酵素である。
この酵素はATPを加水分解し、その際に放出されるエネルギーを利用して細胞内からナトリウムイオンを汲み出して、カリウムイオンを細胞内に取り込んでいる。
すなわち、2種類のイオンを逆方向に輸送している。この結果、細胞内のナトリウム濃度は細胞外よりも低く、カリウムイオンの濃度は細胞外よりも高くなる。