平成27年度 入学者のみなさんに
第4章 水溶液と緩衝作用CHEMISTRY
4-1 水溶液の濃度と性質
 水溶液の濃さを表す方法にはいろいろある。
水溶液の濃さを表す方法にはいろいろある。
質量パーセント濃度(%)は溶質の質量÷溶液の質量から算出する。これは輸液の濃度をあらわす時に使われる。
5%ブドウ糖液100mlの中にはブドウ糖が5g入っている。
質量モル濃度は溶媒1kgに溶解している溶質のモル数で表される。これは凝固点降下や沸点上昇で用いられる濃度である。
体積モル濃度は溶液1リットルに溶解している溶質のモル数で表される。これが化学における一般的な濃度である。通常、モル濃度といえば体積モル濃度である。ヒトの血液ではこの濃度を用いる
4-2 浸透圧
 半透膜は、水は通りぬけるが、溶質分子は通れない膜である。
半透膜は、水は通りぬけるが、溶質分子は通れない膜である。
細胞膜は半透膜であるので、ヒトの細胞でも同じ現象がおこる
濃度差を少なくするために水は濃い食塩水に向かって移動する。
すると食塩水のほうの液面が上昇する。
食塩水が濃ければ濃いほど液面は上昇する。
この液面を同じ高さにしておくために必要な、上から水溶液を押す圧力を浸透圧という。この圧は溶液の濃度が濃いほど高い。
4-3 化学平衡
ヨウ素は500度では気体である。
水素とヨウ素を容器に入れて500度にした場合を考える。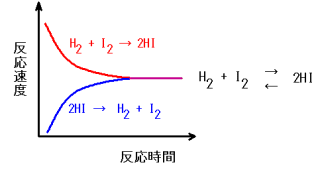
赤線で示す正反応の反応、すなわち水素とヨウ素からヨウ化水素のできる反応の速度は、最初は大きいが、だんだん水素とヨウ素の濃度が減少するので速度は減少してくる。
一方、最初はヨウ化水素が存在しないので青線で示す逆反応の速度は0だが、その後ヨウ化水素が生成されてくるために、ヨウ化水素が水素とヨウ素になる逆反応の速度はだんだん増加する。
そして正反応と逆反応の速度が同じになると、みかけ上は反応が静止したようにみえる。これが化学平衡である。
止まってみえるだけで、中では分子がひたすら反応している。
この化学平衡の条件を変えると平衡が移動することがある。これを平衡移動という。
平衡移動によってまた新たな平衡が成立する。
平衡は外部の変化の影響を和らげる方向に進む。これが重要な原則である。
化学平衡の条件とは濃度、圧力、温度、触媒などである。
濃度で言えば、濃くなったら平衡は薄くなるほうに進む。つまり、加えた物質は減らし、減らした物質は補う方向に平衡が動く。
水素とヨウ素が500度の容器に入っている場合、この中に水素を加えると、水素は増えすぎなので、水素を減らす方向に平衡が動く。
だから正反応の方向、すなわち水素とヨウ素からヨウ化水素ができる方向に平衡が移動する。
水素が減るといっても、加えた量の一部が減るだけであって、加える前の状態より少なくなることはない。
また水素とヨウ素からヨウ化水素ができる反応のほうが優位になるので、ヨウ素は水素を加える前よりも減る。
まとめると、水素とヨウ素が入っている容器に水素を加えると、水素は加えた分の一部しか増えない。ヨウ素は水素を加える前より減少し、ヨウ化水素は水素を加える前よりも増加する。
4-4 緩衝作用
 二酸化炭素が水に溶けると弱酸性の炭酸H2CO3を作る。
二酸化炭素が水に溶けると弱酸性の炭酸H2CO3を作る。
さらに炭酸は水素イオンと重炭酸イオンに電離する。
化学反応式は![]()
![]()
二酸化炭素が溶けた水の中には、二酸化炭素、水、炭酸、水素イオン、重炭酸イオンの5種類があるが、炭酸は数が少ないので今回は無視します。
では緩衝作用について図で説明します。
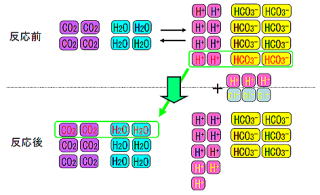
最初は二酸化炭素が4つと水が4つ、水素イオンが8つ、重炭酸イオンが8つありました。
ここに強酸である塩酸HClを加えます。
図のHClは水素イオン3つとクロールイオン3つ分です。
緩衝作用がなければ水素イオンの数が3つ増えて合計11個になり、酸性が強くなります。
炭酸・重炭酸系は緩衝作用がありますのでこうはなりません。
水素イオンが増えるので、緩衝液はこれを増やさないように努力します。
水素イオンが減るように反応式(2)の反応を左に進め、そのまま反応式(1)の反応も左に進めます。
この緩衝液は水素イオンを減らす代わりに二酸化炭素と水を増やします。
反応後は水素イオンの数が9個と、反応前より1個増えただけにとどまりました。緩衝作用がなければ3個増えたところでした。
そして反応後には二酸化炭素が2個と水が2個増えました。二酸化炭素は増えてもいいのです。ヒトは呼吸によって二酸化炭素を体外に排出することができるので、呼吸回数を増やせばいいのです。このことで酸性が強くならないですみました。。
これがヒトの血液で行われている緩衝作用です。病気によって体内に異常な酸が発生した場合には、血液のpHをできるだけ変化させないように二酸化炭素を増やし、これを呼吸によって体外に排出しているのです。
感動しましたか。