平成27年度 入学者のみなさんに
第3章 イオンとpHCHEMISTRY
3-1 イオン結合
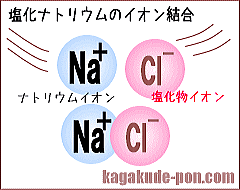 イオン結合は金属元素と非金属元素の原子が結合する時に、金属イオンが陽イオンに、非金属イオンが陰イオンになって、静電気力でつながってできる結合である。
イオン結合は金属元素と非金属元素の原子が結合する時に、金属イオンが陽イオンに、非金属イオンが陰イオンになって、静電気力でつながってできる結合である。
プラスマイナスの静電気の引力をクーロン力ともいう。
NaClはナトリウムイオンととクロールイオンが静電気的な力で結びついている化合物である。
イオン結晶は固体のままでは電気を通さないが、水溶液や融解液でイオンがバラバラになると電気を通す。
3-2 pH(ペーハー)
 pH(ペーハー)は酸性、アルカリ性の指標である。
pH(ペーハー)は酸性、アルカリ性の指標である。
pHはH+(水素イオン)のモル濃度から計算できる。
H+のモル濃度を[H+]であらわし、
[H+]が1×10−□ mol/lである時にpHを□と言う。
[H+]が1×10−2 mol/l、すなわち0.01mol/lである時はpH2と言う。
[H+]が1×10−3 mol/l、すなわち0.001mol/lである時にはpH3と言う。
だから、pHが1違うと濃さは10倍違う。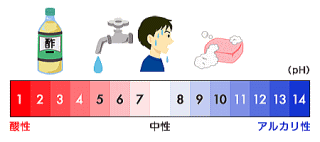
pHが7の時が中性である。すなわち[H+]が1×10−7 mol/lである時である。
pHが7より小さい時が酸性である。pHが7より大きい時が塩基性(アルカリ性)である。
3-3 二酸化炭素
二酸化炭素CO2は酸性気体である。
水に溶けて弱酸性の炭酸H2CO3を作る。
化学反応式は![]()
![]()
(式:二酸化炭素が水に溶けると炭酸になり、さらに炭酸は水素イオンを放出して重炭酸イオンになる。
この反応は矢印の方向を見てもらえればわかるように、左右いずれの方向にも進行する)
この水素イオンと重炭酸イオンは血液の酸性、アルカリ性を考えるときに重要である。