第2章 化学入門ⅡCHEMISTRY
2-1 酸、アルカリと中和
 酸とは水に溶かしたときに酸性を示す物質のことである。なめてみると酸っぱい味がするそうだが、危険なのでなめないほうがいい。
酸とは水に溶かしたときに酸性を示す物質のことである。なめてみると酸っぱい味がするそうだが、危険なのでなめないほうがいい。
酸性を示す水溶液には塩酸、硫酸、レモン汁、食酢、炭酸などがある。
炭酸は二酸化炭素の水溶液である。
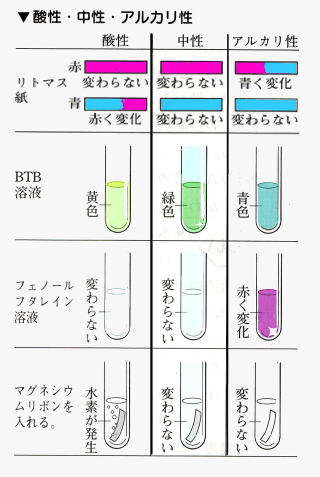
酸性では青色リトマス紙が赤色に変わる。
緑色のBTB液が黄色に変わる。
無色のフェノールフタレイン液を加えると無色のまま。
酸の中にアルミニウム、亜鉛、マグネシウム、鉄などの金属を入れると水素が発生して溶ける。
この場合の金属としてはマグネシウムリボンがよく使われる。
アルカリとは水に溶かしたときにアルカリ性を示す物質のことである。なめてみると渋い味がするそうだが、これも危険だからなめないほうがいい。
アルカリ性を示す水溶液にはアンモニア水、石灰水、水酸化ナトリウム水溶液などがある。
なお、石灰水は水酸化カルシウムの水溶液である。
アルカリ性では赤色リトマス紙が青色に変わる。緑色のBTB液が青色に変わる。無色のフェノールフタレイン液を加えると赤色に変化する。
アルカリの中にアルミニウム、亜鉛などの金属を入れると水素が発生して溶ける。マグネシウムリボンは溶けない。
水、食塩水、砂糖水のようにリトマス紙の色も緑色のBTB液の色も変えない性質を中性という。
酸性の水溶液とアルカリ性の水溶液をちょうどいい量で混ぜ合わせると中性の水溶液になる。このような反応を中和という。
酸性の水溶液とアルカリ性の水溶液を混ぜ合わせると新しい物質ができる。このように中和によってできた物質を塩(えん)という。
酸とアルカリの組み合わせでいろいろな塩(えん)ができる。たとえば塩酸と水酸化ナトリウム水溶液をちょうどいい量で混ぜ合わせると食塩水になる。
中和によって塩(えん)ができる時に同時に水もできる。つまり酸とアルカリを混ぜると塩と水ができる。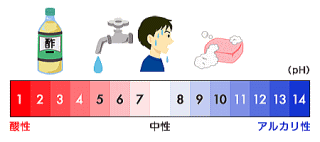
酸やアルカリの強さを0から14の15段階に分類する方法があり、単位はpH(ペーハー)が用いられる。
pH7(ペーハーなな)が中性である。
数字が小さいほど酸性が強く、大きいほどアルカリ性が強い。
万能試験紙を用いるとおよそのpHがわかる。
2-2 原子、分子
 物質を作る最小の粒子を原子という。
物質を作る最小の粒子を原子という。
原子は種類によって質量や大きさが決まっており、他の原子に変化したり消えたり出現したりすることはない。
原子は現在、103種類ある。
分子は物質の性質を持つ最も小さな粒子であり、原子が結びついてできたものである。
だから分子を分割すると物質の性質は失われる。
固体、液体、気体の状態は分子の配列や運動のしかたの違いによるもので、分子そのものの変化によるものではない。
 最も分子の運動が激しく、体積が大きいのは気体である。
最も分子の運動が激しく、体積が大きいのは気体である。
また、通常は液体が固体になったほうが体積は小さくなるが、水は例外である。
氷が規則正しい結晶構造を持ち、水に比べてすき間の多い構造になっているので、水よりも体積が大きくなってしまっている。
化学反応では原子の組み合わせが変わるので、それぞれの分子が変化する。
各原子には元素記号がつけられている。
原子の重さ、すなわち原子量の軽い順に並べると、よく似た性質が周期的に並ぶことがわかる。これを表にしたものを元素の周期表という。 なお、原子量とは炭素原子の質量を12として比べたときの質量をいう。
なお、原子量とは炭素原子の質量を12として比べたときの質量をいう。
化学式とは元素記号を用いて物質を表したものである。
化学式には分子式や組成式がある。
分子構造をとらないイオン化合物などでは
分子式と言わずに組成式というべきである。
たとえばNaCl(食塩)は組成式で、CO2は分子式である。
化学式の中で1種類のみの原子でできているものを単体といい、水やNaCl(食塩)のように、2種類以上の物質に分解できる物質を化合物という。
元素の周期表のなかで覚えるべき元素記号
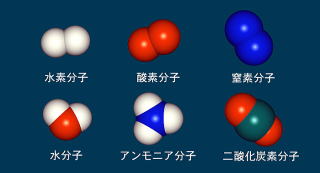
『H』水素、『C』炭素、『N』窒素、『O』酸素。
『Na』ナトリウム、『Mg』マグネシウム、『P』リン、『Cl』塩素。
他に重要なのは『K』カリウム、『Ca』カルシウム、『Fe』鉄、『Hg』水銀
覚えるべき化学式
『H2O』水、『O2』酸素分子、『H2』水素分子、『N2』窒素分子、『CO2』二酸化炭素、
『NH3』アンモニア、『HCl』塩酸、『NaCl』塩化ナトリウム、『H2CO3』炭酸。
2-3 電荷と化学式
2つ以上の物質が結びついて別の1種類の違う性質をもった物質ができる化学変化を化合という。
これによってできた物質を化合物という。
イオン化合物は水に溶かすと陽イオン、陰イオンに分かれる。

ここで化合物の化学式を作るために原子の電荷を覚えておく
1価の陽イオンには、H+(水素イオン)、Na+、(ナトリウムイオン)、K+(カリウムイオン)がある。
2価の陽イオンにはCa2+(カルシウムイオン)がある。
1価の陰イオンにはCl-(クロールイオン)、OH-(水酸化物イオン)、HCO3-(重炭酸イオン)
2価の陰イオン:CO32-(炭酸イオン)がある。
ナトリウムイオンの電荷はNa+なので、電荷としては1価の陰イオンが釣り合う。だからCl-とNaClで化合する。
カルシウムイオンの電荷はCa2+なので、1価の陰イオンと化合するときは1価の陰イオンが2つ必要になる。だから化学式はCaCl2となる。
カルシウムイオンの電荷はCa2+なので、2価の陰イオンCO32-と化合するときはこれがが1つあればいい。だから化学式はCaCO3となる。
ナトリウムイオンの電荷はNa+なので、2価の陰イオンCO32-と化合するときはナトリウムイオンが2つ必要になる。だから化学式はNa2CO3となる。