平成27年度 入学者のみなさんに
第1章 化学入門ⅠCHEMISTRY
1-1 水溶液の重さと濃さ
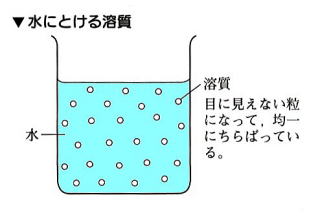 食塩が水に溶けると見えなくなる。これは食塩が非常に小さい粒になったからである。
食塩が水に溶けると見えなくなる。これは食塩が非常に小さい粒になったからである。
消えたわけではない。
水溶液で溶かす液を溶ばい(ようばい)といい、溶かす物を溶質(ようしつ)という。
食塩水では溶ばいは水で、溶質は食塩である。
溶かす前の食塩の重さと水の重さを量って、
足し算する。次にこれを混ぜた食塩水の重さを量る。するとこの二つの数値は同じになる。
溶ばいに溶質を溶かして水溶液にすると、
水溶液は重くなるが、体積はほとんど変化しない。
食塩が水と水の粒の隙間に入るから、食塩の体積と水の体積を加えた値よりも、食塩水の体積は小さい。
水100mlに食塩30gを溶かすと、食塩水の体積は約110mlになる。食塩水の重量は130gになる。
水溶液の濃さは水の量と溶けているものの量、つまり溶質の量によって決まる。同じ体積の水溶液でも溶質がいっぱい溶けていれば、水溶液は濃くて、重さは重い。
水100mlに10gの食塩を溶かした水溶液と、水200mlに20gの食塩を溶かした水溶液では、濃さは同じである。
濃さを比較する時は、水の量を同じにして考えるか、溶質の量を同じにして考える。
水溶液の濃さのことを濃度(のうど)という。
これ以上溶質が溶けきれない濃度の水溶液を飽和水溶液(ほうわすいようえき)という。
1-2 酸素と二酸化炭素の発生法
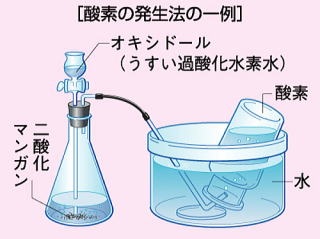 酸素を作るには二酸化マンガンという黒い粒に過酸化水素水(かさんかすいそすい)を注ぎ、集気びんを使って水上置かん法で集める。
酸素を作るには二酸化マンガンという黒い粒に過酸化水素水(かさんかすいそすい)を注ぎ、集気びんを使って水上置かん法で集める。
過酸化水素水は分解されて水と酸素に分かれる。
水上置かん法で集めるのは酸素は水に溶けにくいという性質があるからである。
酸素の性質は色がない、においがない、味がない。空気より重い。空気中の約21%が酸素である。
水に溶けにくい。物が燃えるのを助ける。
酸素自身は燃えないが空気中よりも激しく燃える。
動物が生きていくために必要である。
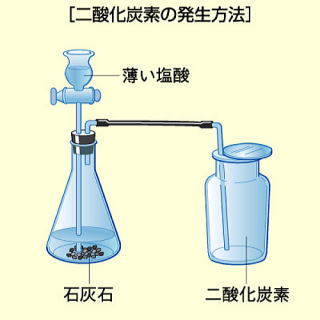 二酸化炭素を作るには炭酸カルシウムの豊富な大理石にうすい塩酸を加える。
二酸化炭素を作るには炭酸カルシウムの豊富な大理石にうすい塩酸を加える。
集めるのは下方置かん法がいい。
二酸化炭素の性質は色がない、においがない、味がない。
空気より重い。酸素より重い。空気中の約0.03%が二酸化炭素である。
二酸化炭素は水に溶けやすい。水に溶かしたものを炭酸水という。
水酸化カルシウムが溶けた石灰水を白くにごらせる。物が燃えるのを助けない。
1-3 酸性、中性、アルカリ性
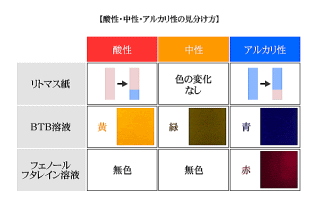 いろいろな水溶液はリトマス紙を使ってなかま分けすることができる。
いろいろな水溶液はリトマス紙を使ってなかま分けすることができる。
酸性では青色リトマス紙が赤色に変わる。
アルカリ性では赤色リトマス紙が青色に変わる。
中性では変わらない。
BTB溶液を使った場合には酸性では緑色が黄色に変わる。
アルカリ性では緑色が青色に変わる。中性では緑色のままである。
フェノールフタレイン液は無色、透明な液体で、アルカリ性の場合だけ赤色になる。
酸性の水溶液とアルカリ性の水溶液をちょうどいい量で混ぜ合わせると中性の水溶液になる。たとえば塩酸と水酸化ナトリウム水溶液をちょうどいい量で混ぜ合わせると食塩水になる。